Em consequência, 10 mil lagos na Suécia estão praticamente mortos. Na Noruega, outros 2 mil perderam seus peixes.
E na Alemanha, mais de 35% das florestas estão doentes. O Taj Mahal, um dos mais belos monumentos hindus, está perdendo a sua cor branca. E na Península de Yucatán, ao sul do México, a chuva está rapidamente destruindo obras da civilização maia, que floresceu ali pelo menos 1500 anos antes da chegada do homem branco.
No Brasil, a poluição da chuva quase não é estudada. Isso não quer dizer que os aguaceiros que aqui desabam sejam sempre limpos. Há cerca de 13 anos atrás, pesquisadores da Universidade Federal Fluminense constataram que a vegetação da Floresta da Tijuca, no Rio de Janeiro, estava sendo afetada pela sujeira da chuva.
Outros estudos, realizados pela Universidade Federal de Vicoca, mostraram que a flora do Parque Florestal do Rio Doce, nas proximidades do Vale do Aço, também tinha sido atingida. Apesar disso, um dos pesquisadores da Cetesb afirmou que, "o problema não tem a gravidade que adquiriu em outros países."
Como sempre, em todos os lugares onde a chuva está servindo de meio de transporte para a poluição, os vilões da história são as indústrias e os veículos que despejam no ar, todos os dias, toneladas de dióxido de enxofre e óxidos de nitrogênio. Esses gases reagem com o vapor de água e outros compostos químicos da atmosfera para formar o perigoso ácido sulfúrico e o ácido nítrico. Apesar dos compostos serem perigosos, o problema da chuva acida é a degradação do meio ambiente a longo prazo.
Alem de poluir rios e lagos e acabar com a flora e a fauna aquática, a chuva ácida se infiltra no solo liberando certos metais potencialmente tóxicos, como alumínio, chumbo e cádmio. Estes podem se introduzir na cadeia alimentar através de plantas e acabar prejudicando a saúde do homem.
Ao contrário do que se imagina, mesmo nos locais mais limpos, como o Ártico, a água da chuva é levemente ácida, ou seja, tem pH 5,6. O pH mede o teor de íons positivos de hidrogênio de uma solução (por uma convenção, pH designa o universo do logaritmo da concentração desses íons). A tabela do pH vai do zero ao quatorze : quanto maior for a concentração daqueles íons, menor será o pH, logo, mais ácida a chuva.
Em várias cidades do oeste da Europa e do leste dos EUA, a chuva chegou a ter pH entre 2 e 3, ou seja, entre o do vinagre e o do suco de limão.
A diferença é maior do que parece : uma chuva com pH 3 contém dez vezes mais hidrogênio do que outra com pH 4 e cem vezes mais do que outra com pH 5.
O conceito de chuva ácida vai mais além : a acidez é a ponta do iceberg. Como a manifestação mais óbvia de que a chuva está poluída é o baixo pH, adota-se o nome chuva ácida para qualquer precipitação com alto teor de poluentes.
Nesses últimos anos, quando o homem parece acordar para os estragos que vem causando à natureza, a chuva ácida costuma ser citada – até com certo exagero – como uma espécie de holocausto ecológico em forma líquida. Mas a ameaça é quase tão antiga quanto a própria Revolução Industrial. A expressão foi usada originalmente no século passado, mais precisamente em 1872, quando o químico inglês Robert Argus Smith analisou a qualidade do ar da cidade de Manchester. No seu livro Air and rain : the beginning of a chemical climatology ( Ar e chuva : os inícios de uma climatologia química ). Smith estabelece pela primeira vez uma ligação entre o pH da chuva e a combustão do carvão naquele centro industrial.
Quase meio século depois, o biólogo norueguês Knut Dahl reconhecia a relação entre a acidez das chuvas e a morte de plantas e peixes em vários lagos de seu país.
Os lagos saudáveis em toda a Escandinávia teriam um pH em torno de 7,0. Em muitos deles, esse valor baixou para 5,0. A acidez matou algas, plânctons e insetos. Sem esta vida microscópica, as águas adquiriram uma transparência não natural. Depois, à medida que o pH abaixava, desapareceram os peixes, em especial salmões e trutas. Enfim, os pássaros, sem ter o que comer, também sumiram.
Na primeira Conferência Mundial do Meio Ambiente, realizada em Estocolmo, em 1972, os suecos deram o alerta. Se a guerra química do homem contra a natureza continuasse, em cinquenta anos, calcularam eles, metade dos lagos de seu país estariam mortos. Por ironia da sorte – ou mais exatamente devido ao complexo mecanismo do clima no planeta – , suecos e noruegueses estavam arcando com um desastre armado a mil quilômetros de distância, na industrializada Inglaterra.
As correntes de ar que se deslocavam do oceano para o continente carregavam a maior parte dos 5 milhões de toneladas anuais de dióxido de enxofre expelidas pelas centrais elétricas movidas a carvão das Ilhas Britânicas.
Quando alcança o sul da Noruega e o sudoeste da Suécia, a mistura poluída se precipita sob a forma de chuva. Calcula-se que algumas regiões da Suécia chegaram a ser contempladas todo ano com um presente grego : 2 gramas de ácido sulfúrico por metro quadrado de chão.
A Península Escandinava não foi a única premiada. As emissões de dióxido de enxofre foram estimadas em 70 milhões de toneladas anuais. Esses gases não respeitaram fronteiras : Alemanha, França, República Theca e Eslováquia, a ex-URSS, Itália e Espanha tiveram sua cota de participação no involuntário comércio internacional de poluição. No Brasil, a termelétrica de Candiota, em Bage, RS, por queimar carvão de má qualidade, acidifica as chuvas que caem no Uruguai. Paradoxalmente, até as medidas antipoluentes adotadas na década de 70 contribuíram para o mercado exportador de chuva ácida. Foi o que aconteceu, por exemplo, no Parque Nacional de Adirondack, uma extensa área verde nos EUA, com montanhas e lagos aprazíveis, protegidos por uma rigorosa legislação de defesa do meio ambiente.
Ninguém imaginaria que naquele paraíso terrestre houvesse qualquer sinal de poluição. Mas em 1976 constatou-se que os peixes de mais da metade dos lagos de Adirondack haviam desaparecido. De onde veio o veneno que teria acabado com eles ? O autor do crime estava a cerca de 800 quilômetros do Parque. Tratava-se do complexo siderúrgico de Sudbury, em Ontário, no Canadá.
Para impedir que a poluição prejudicasse as áreas vizinhas, em Sudbury as chaminés têm descomunais 400 metros de altura. Lançados às camadas mais altas da atmosfera, os gases venenosos são levados por ventos que sopram para o leste até encontrar a barreira dos Montes Apalaches e se precipitar como chuva ácida em pleno parque. Os americanos se queixaram, mas não puderam fazer papel de vítima inocente. Segundo pesquisas, o Canadá recebe dos EUA quatro vezes mais dióxido de enxofre e onze vezes mais óxido de nitrogênio do que envia para esse país.
As florestas da America do Norte não foram afetadas pela chuva ácida. Mas na Europa, os efeitos parecem devastadores. Na Alemanha, Suíça, França e Áustria, as arvores estão doentes, talvez porque o solo ou o tipo de vegetação seja especialmente vulnerável à acidez. Na Alemanha, uma paisagem desoladora : pinheiros e abetos, antes grandiosos, apresentam folhagem amarelada, com manchas escuras que provam a falta de nutrientes ( cálcio e magnésio ). As árvores mais afetadas já perderam a folhagem: os troncos nus estão cobertos de ramos finos, raquíticos e quebradiços.
Nas cidades, a corrosão dos monumentos, edifícios e veículos e de duas a dez vezes mais rápida do que no campo. Na região de Katowice, no sul da Polônia, por exemplo, os trens não podem correr a mais de 40 km/h devido à corrosão dos trilhos. Os gregos, por sua vez, estão lutando contra o tempo para contra-atacar a chuva ácida que aos poucos dissolve seus conhecidos monumentos históricos. Segundo alguns especialistas, alguns dos grandes templos como o Partenon, em Atenas, se deterioraram mais nesse último quarto de século do que em todos os 2400 anos anteriores. A poluição praticamente já apagou as delicadas frisas e figuras gravadas na entrada da construção.
Ali, a solução de ácido sulfúrico reage com o mármore transformando a superfície em gesso macio. Problema semelhante se suspeita que esteja ocorrendo com o Coliseu, em Roma. Às vezes, são falsos alarmes. Quando as esculturas dos doze profetas, obra em pedra-sabão do Aleijadinho, na cidade mineira de Congonhas do Campo, começaram a ser corroídas, afirmou-se que a culpada era também a chuva ácida. Dessa vez, parece que tudo não passou de um ataque de fungos. Melhor sorte não tiveram os monumentos no sul do México. Um estudo mostrou que as esculturas e as ruínas maias estão sendo destruídas pela chuva ácida.
Na America do Sul, chuvas com pH médio 4,7 têm sido registradas tanto em regiões urbanas e industrializadas como em regiões remotas. Isso não quer dizer que a poluição esteja se espalhando. Por exemplo, estudos realizados na floresta amazônica mostraram que os valores do pH na região ( entre 4,5 e 4,7 ) estão próximos daqueles observados em áreas das cidades de São Paulo e Rio de Janeiro. A explicação é natural. A chuva ácida provém da oxidação do sulfeto de hidrogênio, ou seja, a reação do sulfeto em contato com o oxigênio do ar, que se volatiliza nas regiões alagadas. Mas resulta principalmente da grande quantidade de ácidos orgânicos emitidos pela própria floresta.
Fonte: www.bio2000.hpg.ig.com.br
Chuva Ácida
A chuva ácida é uma das principais consequências da poluição do ar. As queimas de carvão ou de petróleo liberam resíduos gasosos, como óxidos de nitrogênio e de enxofre. A reação dessas substâncias com a água forma ácido nítrico e ácido sulfúrico, presentes nas precipitações de chuva ácida.
Os poluentes do ar são carregados pelos ventos e viajam milhares de quilômetros; assim, as chuvas ácidas podem cair a grandes distâncias das fontes poluidoras, prejudicando outros países.
O solo se empobrece, a vegetação fica comprometida. A acidificação prejudica os organismos em rios e lagoas, comprometendo a pesca. Monumentos de mármore são corroídos, aos poucos, pela chuva ácida.
Prejuízos para o homem
1. Saúde
A chuva ácida libera metais tóxicos que estavam no solo. Esses metais podem alcançar rios e serem utilizados pelo homem causando sérios problemas de saúde.
2. Prédios, casas, arquiteturas
A chuva ácida também ajuda a corroer os materiais usados nas construções como casas, edifícios e arquitetura, destruindo represas, turbinas hidrelétricas etc.
Prejuízos para o meio ambiente
1. Lagos
Os lagos podem ser os mais prejudicados com o efeito da chuva ácida, pois podem ficar totalmente acidificados perdendo toda a sua vida.
2. Desmatamentos
A chuva ácida faz clareiras, matando duas ou três árvores. Imagine uma floresta com muitas árvores utilizando mutuamente, agora duas árvores são atingidas pela chuva ácida e morrem e assim vão indo até formar uma clareira. Essas reações podem destruir florestas.
3. Agricultura
A chuva ácida afeta as plantações quase do mesmo jeito que das florestas, só que é destruída mais rápido já que as plantas são do mesmo tamanho, tendo assim mais áreas atingidas.
Como evitar a Chuva Ácida:
-
Conservar energia
-
Transporte coletivo
-
Utilização do metrô
-
Utilizar fontes de energia menos poluentes
-
Purificação dos escapamentos dos veículos
-
Utilizar combustíveis com baixo teor de enxofre.
Fonte: jmacedoc.sites.uol.com.br
Chuva ácida

As chuvas ácidas são um sério problema de agressão ao meio ambiente, são gotas de água que podem ser chuva ou neblina carregadas de ácido nítrico e sulfúrico. Esses ácidos são resultados de reações químicas que correm na atmosfera a partir da presença do enxofre. O enxofre, por sua vez, é emitido para a atmosfera pelas indústrias, pela queima de carvão, pelos veículos, etc. Ela pode manifestar-se tanto no local de origem, como a centenas de quilômetros de distância.
As chuvas ácidas são um sério problema de agressão ao meio ambiente, são gotas de água que podem ser chuva ou neblina carregadas de ácido nítrico e sulfúrico. Esses ácidos são resultados de reações químicas que correm na atmosfera a partir da presença do enxofre. O enxofre, por sua vez, é emitido para a atmosfera pelas indústrias, pela queima de carvão, pelos veículos, etc. Ela pode manifestar-se tanto no local de origem, como a centenas de quilômetros de distância.
A ação corrosiva do ácido é impiedosa, provoca acidificação do solo, prejudicando as plantas e animais, a vida dos rios e florestas. Da mesma forma as edificações presentes na área são afetadas, o excesso de nitrogênio lançado pela chuva ácida em determinados lagos também pode causar crescimento excessivo de algas, e conseqüentemente perda de oxigênio, provocando um significativo empobrecimento da vida aquática.

No Brasil, durante muito tempo e até recentemente, a maior e mais famosa região industrial poluidora do meio ambiente era Cubatão. Todos os tipos imagináveis de poluição e de agressão ao meio ambiente podiam ser encontrados nesse enorme complexo industrial, que apresenta uma grande siderúrgica (Cosipa) e uma refinaria de petróleo (Presidente Bernardes), além de inúmeras indústrias químicas (fertilizantes, sabão, etc). Poluindo atmosfera, chuva ácida, chuva química, poluição dos rios, destruição da vegetação da Serra do Mar, população afetada com problemas respiratórios, abortos e crianças nascendo sem cérebro foram alguns dos problemas ambientais que deram fama a Cubatão como uma das cidades mais poluídas do mundo.

No mundo as chuvas e neblinas carregadas de ácidos são responsáveis pelo "desgastes" de esculturas de mármore, como ocorre em Atenas e em todos os grandes centros poluídos por automóveis e fábricas do mundo.
No mundo as chuvas e neblinas carregadas de ácidos são responsáveis pelo "desgastes" de esculturas de mármore, como ocorre em Atenas e em todos os grandes centros poluídos por automóveis e fábricas do mundo.

Na Europa esse problema é muito grave, pela antiguidade das obras expostas a céu aberto. É o chamado Câncer de Pedra, que faz com que seja necessário recolher essas obras de arte, substituí-las por réplicas e somente expô-las em ambientes fechados. Infelizmente, muitas obras de arte e monumentos antigos, já se acham completamente destruídos pela corrosão provocada pelas chuvas ácidas.

As chuvas ácidas também tem provocado a destruição completa da flora e da fauna aquática de numerosos lagos nos Estados unidos, no Canadá e na Suécia, também as florestas, como a Floresta Negra na Alemanha, vêm sofrendo os efeitos dessa poluição. Floresta Negra é o nome dado a floresta de pinheiros típicas do Sul da Alemanha. O controle da chuva ácida tem de ser feito como o emprego de combustíveis de baixo teor de enxofre, com a instalação de sistemas de tratamento de emissões gasosas nas indústrias e no veículos com motor de explosão.

A ingestão de água potável acidificada, por longos períodos , pode causar a doença de Parkinson e de Alzheimer, a hipertensão, problemas renais e principalmente em crianças, danos ao cérebro. Estima-se que nos Estados Unidos a chuva ácida é a terceira maior causa de doenças pulmonares.
Continuando no ritmo de poluição do ar, nos próximos 30 a 40 anos a chuva ácida causará maiores alterações na química dos solos do que as florestas tropicais poderiam suportar.
Fonte: paginas.terra.com.br
Chuva Ácida
Em 1989 cientistas da Holanda noticiaram que um determinado pássaro canoro que habita as florestas daquele país estava produzindo ovos com a casca fina e porosa. Problema similar fora detectado nas décadas de 60 e 70, causado pelo inseticida DDT. Durante as investigações não foi encontrada nenhuma evidência de intoxicação.
Os cientistas resolveram verificar então o suprimento de cálcio disponível para os pássaros na natureza e necessário para a formação de cascas resistentes nos ovos. Aqueles pássaros usavam normalmente como fonte de cálcio, caramujos que constituíam componente importante na dieta. Entretanto, os caramujos haviam praticamente desaparecido das florestas. O solo seco contem normalmente de 5 a 10 gramas de cálcio por quilograma. O cálcio daquela região havia caído para cerca de 0,3 gramas por quilograma de solo, um nível muito baixo para que os caramujos sobrevivessem.
Sem caramujos para comer, os pássaros passaram a se alimentar de sobras de alimentos de galinhas e de outros animais domésticos e sobras de piqueniques, muito comuns na Europa.
A queda no conteúdo de cálcio do solo da Europa e dos Estados Unidos da América foi atribuída à ocorrência de chuva ácida, principalmente da que contem ácido sulfúrico.

Fotografia de uma floresta alemã tirada em 1970

Depois em 1983, após a ação da chuva ácida na região.
Este é um exemplo de como a poluição ambiental pode afetar a natureza, sem que as pessoas se dêem conta do problema.
A chuva ácida é um fenômeno regional e ocorre na mesma região que gera os poluentes que a causa. Por isso mesmo a incidência é grande nas regiões altamente industrializadas e mais densamente povoadas.
A chuva ácida é causada pela presença de gases, principalmente óxidos ácidos de enxofre e nitrogênio, que saem das chaminés industriais e são solúveis em água. Misturados à água presente no ar, hidrolisam formando ácidos que caem sobre a terra juntamente com a chuva.
A chuva não afetada pela atividade humana é pouco ácida, tendo pH em torno de 5,7. Esta acidez baixa é devida à presença de ácido carbônico, H2CO3, formado pela dissolução de CO2 em H2O. Estes níveis de acidez não são prejudiciais ao meio ambiente.
Os poluentes mais sérios na chuva ácida são os ácidos fortes.
No Brasil o exemplo mais marcante de poluição ambiental por chuva ácida foi a destruição da Mata Atlântica na região de Cubatão, na baixada santista. Os gases de nitrogênio e enxofre liberados às toneladas pelas chaminés das indústrias locais, destruíram a vegetação. Neste caso, a relação de causa – efeito era óbvia. A região de Cubatão era uma das mais poluídas em todo o mundo.
Após um enorme esforço feito por parte da comunidade científica, das primeiras organizações não governamentais brasileiras preocupadas com o meio ambiente e da imprensa que se empenhou em denunciar e esclarecer os fatos, foi elaborada uma legislação e montado um sistema de fiscalização que passou a controlar as emissões, forçando as indústrias a tomarem cuidados óbvios com as emissões gasosas.
Entretanto, não são apenas as indústrias que poluem com estes gases. As grandes cidades, com seus inúmeros carros, também são importantes produtoras de chuva ácida.
Dentro dos motores a combustão dos automóveis, são atingidas temperaturas muito altas, suficientes para que ocorra reação entre o nitrogênio e o oxigênio da atmosfera, formando o gás NO:

O óxido nítrico, NO, não é muito solúvel em água, mas pode ser oxidado no ar formando dióxido de nitrogênio:
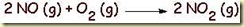
O NO2 reage com água formando ácido nítrico e óxido nítrico:

A legislação brasileira já exige que os carros mais novos sejam equipados, já durante a fabricação, com catalisadores que reduzem o nitrogênio do NO a N2 . Este último gás é um importante componente natural do ar e é muito pouco reativo.
O dióxido de enxofre, SO2 , é produzido como subproduto da queima de combustíveis fósseis, isto é, derivados de petróleo. Ele pode se combinar diretamente com água, formando um ácido fraco, chamado ácido sulfuroso, H2SO3:

Além disso, na presença de material particulado e aerossóis do ar, o dióxido de enxofre pode reagir diretamente com o oxigênio atmosférico e formar trióxido de enxofre, que, por sua vez, produz ácido sulfúrico e água:


O ácido sulfúrico é um ácido forte especialmente prejudicial ao solo porque causa a retirada dos íons de cálcio. A maioria dos solos possui partículas de argilas que são circundadas por íons inorgânicos, inclusive Ca2+. Entretanto os íons de cálcio das argilas podem ser substituídos pelo cátion de hidrogênio liberados pelo ácido sulfúrico. Neste processo também se forma sulfato de cálcio que é insolúvel em água. Desta forma, o cálcio não mais circula no ambiente, deixando de estar disponível no solo para ser usado pelas plantas. Este cálcio retirado do solo não é substituído. As plantas sofrem com a sua falta e as florestas são afetadas.
A pesquisa sobre o impacto da poluição do ar sobre as florestas é difícil. O sistema é altamente complexo. As florestas cobrem áreas muito grandes e a atuação de cada agente poluidor pode ser muito sutil, de modo que o verdadeiro papel desempenhado por cada agente pode levar muitos anos para ser identificado.
De qualquer modo, o controle das emissões de óxidos ácidos deve ser exercido continuamente de modo a melhorar e manter a qualidade de vida da humanidade, sem perda das nossas heranças naturais.
Fonte: cdcc.sc.usp.br
Chuva Ácida
Chuva ácida é um fenômeno recente?
Não. O termo chuva ácida foi cunhado por um químico, Robert Angus Smith, quando descrevia a poluição em Manchester, Inglaterra, há mais de um século. Entretanto, a nível mundial, a percepção da acidez da chuva só ocorreu a partir da década de 1950, quando diversos ecossistemas (lagos e florestas, principalmente) já estavam seriamente comprometidos. Esta percepção tardia deve-se ao fato de que os ambientes naturais possuem um longo tempo de resposta a agressões como a acidificação. A água e o solo possuem a capacidade de neutralizar adições de ácidos e bases, e só depois de esgotada esta capacidade é que o pH destes ambientes sofre mudanças bruscas e acentuadas.
Quais os efeitos da chuva ácida sobre o solo e a vegetação?
A solubilidade de metais potencialmente tóxicos como o alumínio, manganês e cádmio é dependente do pH e aumenta rapidamente com a diminuição do pH da solução do solo. O alumínio é fitotóxico e causa prejuízos ao sistema de raízes, diminuindo a habilidade das plantas para absorver os nutrientes e a água do solo, afetando o crescimento das sementes e a decomposição do folhedo, e interagindo sinergisticamente com os ácidos para aumentar o prejuízo às plantas e aos ecossistemas aquáticos. Outro efeito líquido sobre a vegetação é a redução no seu crescimento ou, no pior caso, a morte, devido não só à lixiviação dos nutrientes como o magnésio e o potássio pelo percolado ácido, mas também por causas secundárias afetando a planta enfraquecida.
As soluções
Incentivar o transporte coletivo.
Utilizar metrôs em substituição à frota de ônibus a diesel.
Incentivar a descentralização industrial.
Dessulfurar os combustíveis com alto teor de enxofre antes da sua distribuição e consumo.
Dessulfurar os gases de combustão nas indústrias antes do seu lançamento na atmosfera.
Subsidiar a utilização de combustíveis limpos (gás natural, energia elétrica de origem hidráulica,energia solar e energia eólica) em fontes de poluição tipicamente urbanas como hospitais, lavanderias e restaurantes.
Utilizar combustíveis limpos em veículos, indústrias e caldeiras.
Fonte: www.fontedosaber.com
E na Alemanha, mais de 35% das florestas estão doentes. O Taj Mahal, um dos mais belos monumentos hindus, está perdendo a sua cor branca. E na Peninsula de Yucatán, ao sul do Mexico, a chuva está rapidamente destruindo obras da civilizacao maia, que floresceu ali pelo menos 1500 anos antes da chegada do homem branco.
No Brasil, a poluição da chuva quase não é estudada. Isso não quer dizer que os aguaceiros que aqui desabam sejam sempre limpos. Há cerca de de 13 anos atrás, pesquisadores da Universidade Federal Fluminense constataram que a vegetacão da Floresta da Tijuca, no Rio de Janeiro, estava sendo afetada pela sujeira da chuva.
Outros estudos, realizados pela Universidade Federal de Vicoca, mostraram que a flora do Parque Florestal do Rio Doce, nas proximidades do Vale do Aço, também tinha sido atingida. Apesar disso, um dos pesquisadores da Cetesb afirmou que, "o problema não tem a gravidade que adquiriu em outros paises."
Como sempre, em todos os lugares onde a chuva está servindo de meio de transporte para a poluição, os vilões da história são as indústrias e os veiculos que despejam no ar, todos os dias, toneladas de dióxido de enxofre e oxidos de nitrogênio. Esses gases reagem com o vapor de água e outros compostos químicos da atmosfera para formar o perigoso ácido sulfúrico e o ácido nítrico. Apesar dos compostos serem perigosos, o problema da chuva acida é a degradação do meio ambiente a longo prazo.
Alem de poluir rios e lagos e acabar com a flora e a fauna aquática, a chuva ácida se infiltra no solo liberando certos metais potencialmente tóxicos, como alumínio, chumbo e cádmio. Estes podem se introduzir na cadeia alimentar através de plantas e acabar prejudicando a saúde do homem.
Ao contrário do que se imagina, mesmo nos locais mais limpos, como o Ártico, a água da chuva é levemente ácida, ou seja, tem pH 5,6. O pH mede o teor de ions positivos de hidrogenio de uma solução ( por uma convenção, pH designa o universo do logaritmo da concentração desses íons ). A tabela do pH vai do zero ao quatorze : quanto maior for a concentração daqueles íons, menor será o pH, logo, mais ácida a chuva.
Em várias cidades do oeste da Europa e do leste dos EUA, a chuva chegou a ter pH entre 2 e 3, ou seja, entre o do vinagre e o do suco de limão.
A diferença é maior do que parece : uma chuva com pH 3 contém dez vezes mais hidrogênio do que outra com pH 4 e cem vezes mais do que outra com pH 5.
O conceito de chuva ácida vai mais além : a acidez é a ponta do iceberg. Como a manifestação mais óbvia de que a chuva está poluída é o baixo pH, adota-se o nome chuva ácida para qualquer precipitação com alto teor de poluentes.
Nesses ultimos anos, quando o homem parece acordar para os estragos que vem causando à natureza, a chuva ácida costuma ser citada – até com certo exagero – como uma espécie de holocausto ecológico em forma líquida. Mas a ameaça é quase tão antiga quanto a própria Revolucão Industrial. A expressão foi usada originalmente no século passado, mais precisamente em 1872, quando o químico inglês Robert Argus Smith analisou a qualidade do ar da cidade de Manchester. No seu livro Air and rain : the beginning of a chemical climatology ( Ar e chuva : os inicios de uma climatologia química ). Smith estabelece pela primeira vez uma ligação entre o pH da chuva e a combustào do carvão naquele centro industrial.
Quase meio século depois, o biólogo norueguês Knut Dahl reconhecia a relaçãoo entre a acidez das chuvas e a morte de plantas e peixes em vários lagos de seu país.
Os lagos saudáveis em toda a Escandinávia teriam um pH em torno de 7,0. Em muitos deles, esse valor baixou para 5,0. A acidez matou algas, plânctons e insetos. Sem esta vida microscópica, as águas adquiriram uma transparência não natural. Depois, à medida que o pH abaixava, desapareceram os peixes, em especial salmões e trutas. Enfim, os pássaros, sem ter o que comer, tambem sumiram.
Na primeira Conferência Mundial do Meio Ambiente, realizada em Estocolmo, em 1972, os suecos deram o alerta. Se a guerra química do homem contra a natureza continuasse, em cinquenta anos, calcularam eles, metade dos lagos de seu país estariam mortos. Por ironia da sorte – ou mais exatamente devido ao complexo mecanismo do clima no planeta – , suecos e noruegueses estavam arcando com um desastre armado a mil quilômetros de distância, na industrializada Inglaterra.
As correntes de ar que se deslocavam do oceano para o continente carregavam a maior parte dos 5 milhões de toneladas anuais de dióxido de enxofre expelidas pelas centrais elétricas movidas a carvào das Ilhas Britânicas.
Quando alcança o sul da Noruega e o sudoeste da Suécia, a mistura poluída se precipita sob a forma de chuva. Calcula-se que algumas regiões da Suécia chegaram a ser contempladas todo ano com um presente grego : 2 gramas de ácido sulfúrico por metro quadrado de chão.
A Peninsula Escandinava não foi a única premiada. As emissões de dióxido de enxofre foram estimadas em 70 milhões de toneladas anuais. Esses gases não respeitaram fronteiras : Alemanha, França, República Theca e Eslováquia, a ex-URSS, Itália e Espanha tiveram sua cota de participação no involuntário comércio internacional de poluição. No Brasil, a termelétrica de Candiota, em Bage, RS, por queimar carvão de má qualidade, acidifica as chuvas que caem no Uruguai. Paradoxalmente, até as medidas antipoluentes adotadas na década de 70 contribuiram para o mercado exportador de chuva ácida. Foi o que aconteceu, por exemplo, no Parque Nacional de Adirondack, uma extensa área verde nos EUA, com montanhas e lagos aprazíveis, protegidos por uma rigorosa legislação de defesa do meio ambiente.
Ninguém imaginaria que naquele paraiso terrestre houvesse qualquer sinal de poluição. Mas em 1976 constatou-se que os peixes de mais da metade dos lagos de Adirondack haviam desaparecido. De onde veio o veneno que teria acabado com eles ? O autor do crime estava a cerca de 800 quilometros do Parque. Tratava-se do complexo siderúrgico de Sudbury, em Ontário, no Canadá.
Para impedir que a poluição prejudicasse as áreas vizinhas, em Sudbury as chaminés têm descomunais 400 metros de altura. Lancados às camadas mais altas da atmosfera, os gases venenosos são levados por ventos que sopram para o leste até encontrar a barreira dos Montes Apalaches e se precipitar como chuva ácida em pleno parque. Os americanos se queixaram, mas não puderam fazer papel de vítima inocente. Segundo pesquisas, o Canadá recebe dos EUA quatro vezes mais dióxido de enxofre e onze vezes mais óxido de nitrogênio do que envia para esse país.
As florestas da América do Norte não foram afetadas pela chuva ácida. Mas na Europa, os efeitos parecem devastadores. Na Alemanha, Suiça, França e Austria, as árvores estão doentes, talvez porque o solo ou o tipo de vegetacão seja especialmente vulnerável à acidez. Na Alemanha, uma paisagem desoladora : pinheiros e abetos, antes grandiosos, apresentam folhagem amarelada, com manchas escuras que provam a falta de nutrientes ( cálcio e magnésio ). As árvores mais afetadas já perderam a folhagem: os troncos nus estão cobertos de ramos finos, raquíticos e quebradiços.
Nas cidades, a corrosão dos monumentos, edificios e veículos é de duas a dez vezes mais rapida do que no campo. Na região de Katowice, no sul da Polônia, por exemplo, os trens não podem correr a mais de 40 km/h devido à corrosão dos trilhos. Os gregos, por sua vez, estão lutando contra o tempo para contra-atacar a chuva ácida que aos poucos dissolve seus conhecidos monumentos históricos. Segundo alguns especialistas, alguns dos grandes templos como o Partenon, em Atenas, se deterioraram mais nesse último quarto de século do que em todos os 2400 anos anteriores. A poluição praticamente já apagou as delicadas frisas e figuras gravadas na entrada da construção.
Ali, a solução de ácido sulfúrico reage com o marmore transformando a superfície em gesso macio. Problema semelhante se suspeita que esteja ocorrendo com o Coliseu, em Roma. Às vezes, são falsos alarmes. Quando as esculturas dos doze profetas, obra em pedra-sabão do Aleijadinho, na cidade mineira de Congonhas do Campo, começaram a ser corroídas, afirmou-se que a culpada era também a chuva ácida. Dessa vez, parece que tudo não passou de um ataque de fungos. Melhor sorte não tiveram os monumentos no sul do México. Um estudo mostrou que as esculturas e as ruínas maias estao sendo destruídas pela chuva ácida.
Na América do Sul, chuvas com pH médio 4,7 têm sido registradas tanto em regiões urbanas e industrializadas como em regiões remotas. Isso não quer dizer que a poluição esteja se espalhando. Por exemplo, estudos realizados na floresta amazônica mostraram que os valores do pH na região ( entre 4,5 e 4,7 ) estao próximos daqueles observados em áreas das cidades de São Paulo e Rio de Janeiro. A explicação é natural. A chuva ácida provém da oxidação do sulfeto de hidrogenio, ou seja, a reação do sulfeto em contato com o oxigenio do ar, que se volatiliza nas regiões alagadas. Mas resulta principalmente da grande quantidade de ácidos organicos emitidos pela própria floresta.
Fonte: www.bio2000.hpg.ig.com.br
Chuva Ácida
A chuva ácida é uma das principais consequências da poluição do ar. As queimas de carvão ou de peróleo liberam resíduos gasosos, como óxidos de nitrôgenio e de enxofre. A reação dessas substâncias com a água forma ácido nítrico e ácido sulfúrico, presentes nas precipitações de chuva ácida.
Os poluentes do ar são carregados pelos ventos e viajam milhares de quilômetros; assim, as chuvas ácidas podem cair a grandes distâncias das fontes poluidoras, prejudicando outros países.
O solo se empobrece, a vegetação fica comprometida. A acidificação prejudica os organismos em rios e lagoas, comprometendo a pesca. Monumentos de mármore são corruídos, aos poucos, pela chuva ácida.
Prejuízos para o homem
1. Saúde
A chuva ácida libera metais tóxicos que estavam no solo. Esses metais podem alcançar rios e serem utilizados pelo homem causando sérios problemas de saúde.
2. Prédios, casas, arquiteturas
A chuva ácida também ajuda a corroer os materiais usados nas construções como casas, edifícios e arquitetura, destruindo represas, turbinas hidrelétricas etc.
Prejuízos para o meio ambiente
1. Lagos
Os lagos podem ser os mais prejudicados com o efeito da chuva ácida, pois podem ficar totalmente acidificados perdendo toda a sua vida.
2. Desmatamentos
A chuva ácida faz clareiras, matando duas ou três árvores. Imagine uma floresta com muitas árvores utilizando mutuamente, agora duas árvores são atingidas pela chuva ácida e morrem e assim vão indo até formar uma clareira. Essas reações podem destruir florestas.
3. Agricultura
A chuva ácida afeta as plantações quase do mesmo jeito que das florestas, só que é destruída mais rápido já que as plantas são do mesmo tamanho, tendo assim mais áreas atingidas.
Como evitar a Chuva Ácida:
- Conservar energia
- Transporte coletivo
- Utilização do metrô
- Utilizar fontes de energia menos poluentes
- Purificação dos escapamentos dos veículos
- Utilizar combustíveis com baixo teor de enxofre.
Fonte: jmacedoc.sites.uol.com.br


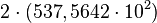
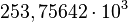
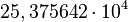


 (não padronizado)
(não padronizado) 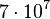 (padronizado)
(padronizado) (não padronizado)
(não padronizado)  (convertido para a notação padronizada)
(convertido para a notação padronizada) (já padronizado sem necessidade de conversão)
(já padronizado sem necessidade de conversão) (padronizado)
(padronizado) (não padronizado)
(não padronizado) 
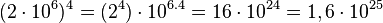 (padronizado)
(padronizado)
![\sqrt[5]{6,7\cdot 10^{17}} = \sqrt[5]{670\cdot 10^{15}} = \sqrt[5]{670}\cdot 10^{15/5} \approx 3,674\cdot 10^{3}](http://upload.wikimedia.org/math/5/f/4/5f4091fa9076fe7b68fdae63b176b459.png)














































































